Estructura de las proteínas
Las proteínas se disponen en el espacio formando estructuras tridimensionales definidas, que tienen hasta cuatro niveles distintos de organización: estructura primaria, secundaria, terciaria y cuaternaria.
Estructura primaria
La estructura primaria la poseen
todas las proteínas. Se refiere a la secuencia de aminoácidos,
es decir, la combinación lineal de los aminoácidos mediante un tipo de enlace
covalente, el enlace peptídico. Es la estructura más sencilla
e importante, ya que determina el resto de estructuras proteicas en niveles
superiores.
La característica principal de esta
estructura es su disposición en zigzag, debido a la planaridad del enlace peptídico,
que provoca la rotación sobre los Cα para equilibrar las fuerzas
de atracción sobre ellas.
Debido a la existencia de 20
aminoácidos, el número de polipéptidos que pueden formarse son de 20 elevado a n, siendo n el número de aminoácidos. Como
la mayoría de péptidos tienen cientos de aminoácidos, la variedad de
posibilidades es casi infinita.

Estructura secundaria
La estructura secundaria de las proteínas es la
disposición espacial que adopta la secuencia de aminoácidos para ser estable,
gracias a la formación de puentes de hidrógeno entre los átomos que forman el enlace peptídico, es decir, un tipo de enlace no covalente,
sin hacer referencia a la cadena lateral. Esto es consecuencia directa de la
capacidad de giro que tienen los carbonos α.
Los modelos más frecuentes son :
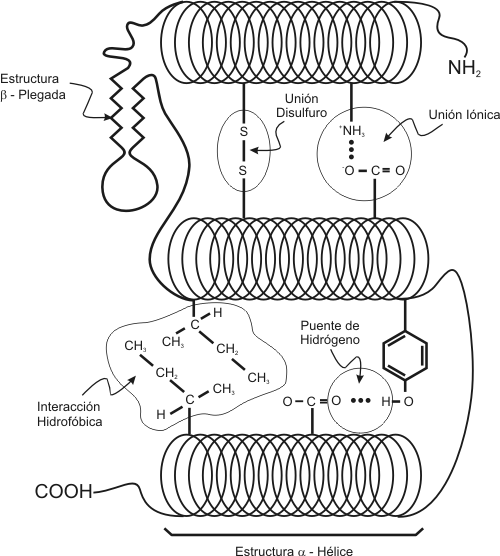
α-hélice: la cadena polipeptídica se enrolla en espiral sobre sí misma debido a los giros en torno a los carbonos α. Esta estructura se mantiene gracias a los enlaces de hidrógeno intracatenarios entre el grupo -NH de un enlace peptídico y el grupo -C=O del cuarto aminoácido consecutivo.
La formación de estos enlaces determina tanto la estabilidad de la estructura como la longitud del paso de rosca, que es de 0,54 nm. La rotación se produce hacia a la derecha, de modo que cada aminoácido gira 100º con respecto al anterior.
El grupo amino del aminoácido (n) puede establecer un enlace de hidrógeno con el grupo carbonilo del aminoácido (n+4). De esta forma, cada aminoácido (n) de la hélice forma dos puentes de hidrógeno con su enlace peptídico y el enlace peptídico del aminoácido en (n+4) y en (n-4). En total son 7 enlaces de hidrógeno por vuelta. Esto estabiliza enormemente la hélice.
La estabilidad de la α-hélice depende de la presencia o no de residuos de prolina o hidroxiprolina, debido a que éstos impiden la formación de enlaces de hidrógeno, dando lugar a varaciones en la estructura.
Conformación β o lámina plegada: algunas cadenas conservan su estrctura primaria en zigzag, y se asocian entre sí con enlaces de hidrógeno intercatenarios. Todos los enlaces peptídicos participan, dotándole de una gran estabilidad.
Las cadenas se pueden unir de dos formas distintas: paralela o antiparalela. En la primera, las cadenas se disponen en el mismo sentido N-C, mientras que en la antiparalela se alternan entre las direcciones N-C y C-N.

Hélice de colágeno: es la estructura secundaria que presenta el colágeno, que forma parte de tendones y el tejido conectivo. Se trata de una estructura rígida.
El colágeno es una proteína compuesta principalmente por prolina. Debido a la repetición de este aminoácido de forma continua la cadena no puede adoptar las formas anteriores, por lo que las cadenas individuales se enrollan hacia la izquierda, produciéndose una vuelta de hélice cada tres residuos.

Estructura terciaria
Es el modo en que
la cadena polipeptídica se pliega en el espacio, es decir, cómo se enrolla una
determinada proteína, ya sea globular o fibrosa. Es la disposición de los dominios en el espacio.
La
estructura terciaria se realiza de manera que los aminoácidos apolares se
sitúan hacia el interior y los polares hacia el exterior en medios acuosos.
Esto provoca una estabilización por interacciones hidrofóbicas, de fuerzas de
van der Waals y de puentes disulfuro(covalentes, entre aminoácidos de cisteína convenientemente orientados) y
mediante enlaces iónicos.
La estructura terciaria de las proteínas, especialmente aquellas con un elevado peso molecular, está constituida por varios dominios o unidades compactas de entre 50 y 300 aminoácidos. En la mayoría de los casos, los dominios se unen entre sí mediante una porción proteica flexible que sirve como bisagra. Frecuentemente, representan partes de la proteína que se unen a otros factores diferentes.
Estructura cuaternaria
La estructura cuaternaria es la que poseen las proteínas, tanto fibrosas como
globulares. Deriva de la conjunción de varias cadenas polipeptídicas que,
asociadas, conforman un multímero, que
posee propiedades distintas a la de sus monómeros, también llamados subunidad o protómero, que son
las cadenas polipéptidos que la componen. Dichas subunidades se asocian entre
sí mediante interacciones no covalentes, como pueden ser puentes de hidrógeno,
interacciones hidrofóbicas o puentes salinos o fuerzas de Van der Waals.
El colágeno es una proteína fibrosa, formada por tres
cadenas polipeptídicas helicoidales entrelazadas para formar una triple hélice
más grande, factor que le confiere a las fibras gran resistencia. La
hemoglobina es una proteína globular compuesta por cuatro cadenas polipeptídicas,
dos de tipo α y dos de tipo β.
Propiedades de las proteínas
Las propiedades de las proteínas dependen de la naturaleza de los radicales (-R) de los aminoácidos.
- Solubilidad: la solubilidad se debe a que solo los grupos -R polares se hallan localizados en la superficie externa de la proteína, y a que establecen enlaces de hidrógeno con el agua, rodeándose de una capa de agua la proteína que impide su unión con otras. Generalmente, las proteínas fibrosas son insolubles en el agua, mientras que las globulares sí lo son.
- Desnaturalización: Si en una disolución de proteínas se producen cambios de pH, alteraciones en la concentración,
agitación molecular o variaciones bruscas de temperatura,
la solubilidad de las proteínas puede verse reducida
hasta el punto de producirse suprecipitación.
Esto se debe a que los enlaces que mantienen la conformación globular se rompen y la proteína adopta laconformación filamentosa.
De este modo, la capa de moléculas de agua no recubre completamente a las
moléculas proteicas, las cuales tienden a unirse entre sí dando lugar a grandes
partículas que precipitan. Además, sus propiedades biocatalizadoras desaparecen al alterarse el centro activo.
Las proteínas que se hallan en ese estado no pueden llevar a cabo la actividad
para la que fueron diseñadas, en resumen, no son funcionales.
Esta variación de la conformación se denomina desnaturalización. La desnaturalización no afecta a los enlaces peptídicos: al volver a las condiciones normales, puede darse el caso de que la proteína recupere la conformación primitiva, lo que se denomina renaturalización.Ejemplos de desnaturalización son la leche cortada como consecuencia de la desnaturalización de la caseína, la precipitación de la clara de huevo al desnaturalizarse la ovoalbúmina por efectodel calor o la fijación de un peinado del cabello por efecto de calor sobre las queratinas del pelo.
- Especifidad: es la propiedad más característica de las proteínas. Se muestra a diversos niveles:
- Especificidad de función. Reside en la posición que ocupan determinados aminoácidos de los que constituyen su secuencia lineal. Esta secuencia condiciona la estructura cuaternaria de la proteína, responsable en última instancia de su función característica. Una pequeña función puede provocar la pérdida de funcionalidad de la proteína.
- Especificidad de especie. Existen proteínas que son exclusivas de cada especie. Lo más común es que las proteínas que desempeñan la misma función en diferentes especies que tengan una composición y estructuras similares. A estas proteínas se les denominan homólogas. Es el caso, por ejemplo, de la insulina, que se encuentra exclusivamente en vertebrados.

- Capacidad amortiguadora. Las proteínas, al tener un comportamiento anfótero, son capaces de amortiguar las variaciones del pH del medio en el que se encuentran.
Y esto, ¿para qué sirve?
La importancia biológica de las proteínas es incuestionable. Forman una gran diversidad de estructuras y tejidos, como la piel. Forma los músculos y permite su contracción, tiene funciones de reserva, enzimática...
Bibliografía
Información: libro de biología de segundo de bachillerato, editorial sm/Wikipedia
Vídeo: Youtube
Fotos: http://www.ehu.es/biomoleculas/proteinas/jpg/renaturation.gif , https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjGavjuRt_Ofd5RcE5CE5rJNDmEej9_QzltnNUsSf308b9rmvycTShcjT7J-KN89HicB8yG_AtAPC8ttvV3WTZWlKj2MRYBGw2Td_WZwrlvuVCG7t7vdm7db3o6OBcaMD41Hhj4OqsERwZ-/s320/p0316.gif , https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgqs6viS4ixNhjjtyBg3nztKjMPmeu1qlsPqIHshPfaciY1onqGdOiMwPAHKmyKZQLNGbbiVw95eQ_8vIC1vSJRcBApq3YfNv9aT8LmlS32Jj2WAN3Ibv1oe0_ieYDrfQ7O4mpw1WoOAYKZ/s400/hemoglobina-191804.jpeg , http://www.genomasur.com/lecturas/02-57-G.gif , http://www.oocities.org/pelabzen/beta.gif , http://oscarmm.mayo.uson.mx/alimentos_archivos/image005.gif ,


























2 comentarios:
No voy a ser yo quien diga que esta entrada está mal...cumple con todos los requisitos planteados. Si me permites una crítica, creo que es demasiado "wikipédico" y reduces la parte más importante que es el "para qué sirve" y algunas aportaciones personales. Así que te invito a que desarrolles esa parte para la próxima, aunque sea reduciendo la parte teórica, que ya la tenemos explicada en el libro de texto. Tenemos que intentar llegar donde no llegan los apuntes o el libro de texto. ¿Vale?
Por cierto...una imagen no se ve.
Publicar un comentario
Gracias por comentar los artículos. Estoy encantado de que te apetezca participar en el blog.