Los aminoácidos son compuestos orgánicos sencillos de bajo peso molecular, que al unirse entre sí forman las proteínas.
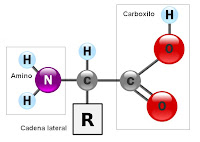
Químicamente están formados por C, H, O y N y su fórmula general es NH2-CHR-COOH.
Como se ve en la fórmula, poseen un grupo amino (-NH2) y un grupo carboxilo (-COOH) unidos covalentemente a un carbono α, al que además se une también un radical (R) que es distinto para cada uno de los aminoácidos y que determina sus propiedades químicas y biológicas.
Se pueden distinguir dos tipos de aminoácidos:
- Aminoácidos proteicos, que son 20 y forman las proteínas.
- Atendiendo a la polaridad de los radicales (R) pueden dividirse a su vez en:
- Hidrófobos: de naturaleza hidrocarbonada no polar.
- Polares hidrofílicos: polares, pero sin carga.
- Básicos: poseen un grupo amino que se ioniza positivamente (capta protones).
- Ácidos: poseen un grupo carboxilo que se ioniza negativamente (cede protones).
- Según si pueden ser sintetizados por los organismos heterótrofos o no se agrupan en:
- Esenciales: no pueden ser sintetizados y deben ser ingeridos en la dieta. Por ejemplo: fenilanina, leucina, lisina, valina...
- No esenciales: pueden ser sintetizados por los organismos a partir de compuestos más sencillos.
Propiedades de los aminoácidos
Son sólidos, solubles en agua, cristalizables, incoloros o poco coloreados y con un punto de fusión alto (200ºC).En disolución acuosa presentan carácter anfótero, es decir, se comportan como ácidos o como bases, en función del valor del pH interviniendo en su regulación.
Presentan un tipo de isomería, denominada estereoisomería. Esto es debido que todos los aminoácidos, excepto la glicocola, tienen al menos un carbono α y como consecuencia pueden presentar dos configuraciones espaciales D y L según si el grupo amino se encuentra a la derecha o a la izquierda. De esta propiedad deriva otra, que es la actividad óptica, también presente en los monosacáridos.
Enlace peptídico
 Los aminoácidos se unen entre sí mediante el enlace peptídico,que se trata de un enlace covalente entre el grupo carboxilo de un aminoácido y el amino de otro, con la pérdida de una molécula de agua, como se refleja en la animación de la derecha.
Los aminoácidos se unen entre sí mediante el enlace peptídico,que se trata de un enlace covalente entre el grupo carboxilo de un aminoácido y el amino de otro, con la pérdida de una molécula de agua, como se refleja en la animación de la derecha. Al producirse este enlace, en la cadena resultante los grupos amino y carboxilo se encuentran en extremos opuestos, llamandose así N-terminal (amino terminal) y C-terminal (carbono terminal).
Los aminóacidos unidos mediante este enlace reciben el nombre de residuos, para resaltar la pérdida de átomos en la formación del enlace. Un dipéptido es una cadena formada por dos residuos, un tripéptido por tres, un oligopéptido por menos de 50 y un polipéptido es una cadena formadas por más de 50 residuos.
En la naturaleza existe un gran numero de estas moléculas que realizan funciones importantes y diversas. Entre ellas destacan las de función hormonal como la oxitocina, la vasopresina, la insulina o el glucagón, las de función antibiótica como la valinomicina o las de función transportadora como el glutatión.
Este enlace presenta unas características de gran importancia para la estructura proteica, como son:
- Es un enlace más corto que la mayoría de los enlaces C-N.
- Posee carácter de doble enlace, lo que le impide girar libremente, menos a los enlaces formados por C-C y N-C, que sí pueden girar.
- Los cuatro átomos del grupo péptido y los dos átomos de carbono se encuentran en el mismo plano, con distancias y ángulos fijos.
Aquí hay una página con unas explicaciones muy claras de estas características.
¿Para qué sirve?
Gracias a los aminoácidos se forman las proteínas, biomoléculas imprescindibles para el mantenimiento de nuestro organismo, ya que ejercen en él funciones muy diversas y relevantes. Además, los aminoácidos por sí mismos desempeñan funciones hormonales, transportadoras o antibióticas.La amplia variedad de proteínas existente y sus variadas funciones tienen su origen en la presencia en los aminoácidos de una gran variedad de radicales, que les confieren sus propiedades químicas y biológicas.
El caracter anfótero de los aminoácidos regula el pH, interviniendo en la homeostasis o mantenimiento del equilibro del medio interno, condición esencial para el buen desarrollo de las funciones bioquímicas y fisiológicas de los organismos.
Bibliografía:
- Libro de Biología de 2º Bachillerato Ed SM.
- http://www.ehu.es/biomoleculas/peptidos/pep2.htm
- http://biologia.laguia2000.com/bioquimica/propiedades-de-los-aminoacidos
- http://www.profesorjano.info/2010/10/materiales-sobre-aminoacidos.html
Lourdes R.V


Ok, ya vais pillando el truco ;-))
ResponderEliminar